In der Regel führen eine Laboruntersuchung nach Blutungen, ein Screening im Zusammenhang mit einer familiären Prädisposition oder ein
Zufallsfund zur Diagnose FVII‑Mangel.2
Bei schwerwiegenden Defekten treten Blutungen bereits im ersten Lebensmonat auf, das mittlere Alter für die Entdeckung eines vererbten
Defekts liegt jedoch bei 8 Jahren.2
Da das Fehlen von FVII mit dem Leben unvereinbar ist, gibt es keine Erkrankungsform, bei der Faktor VII vollständig fehlt.1 Als untere Normgrenze gilt eine FVII‑Aktivität von 70 %.2
- Ein leichter FVII‑Mangel (FVII‑Aktivität > 20 %, aber < 70 %) ist weitgehend asymptomatisch und wird meist zufällig entdeckt.3
- Ein mittelschwerer FVII-Mangel (FVII‑Aktivität 10-20 %) tritt in der Regel während der Pubertät auf, insbesondere bei Frauen während der Menarche.3
- Ein schwerer FVII‑Mangel (FVII‑Aktivität < 10 %) zeigt sich meist in jungen Jahren.3
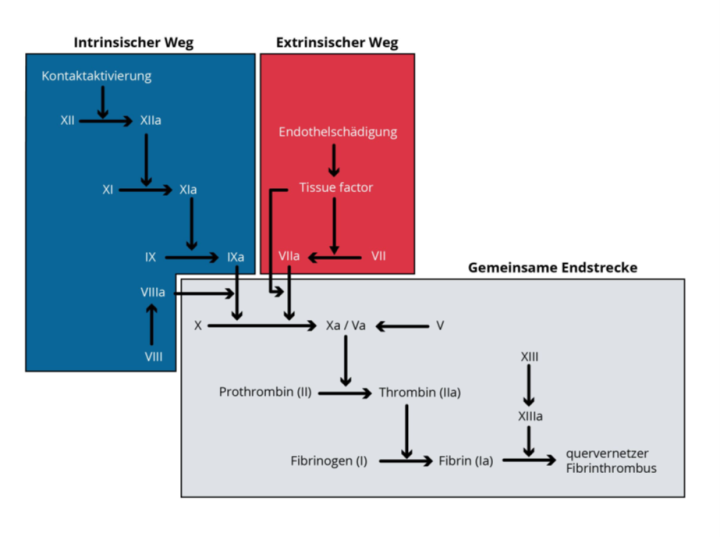
Eine isolierte Verlängerung der Prothrombinzeit (PT) bzw. ein niedriger Quick-Wert bei gleichzeitig normaler partieller Thromboalastinzeit (aPTT) ist Hinweis auf einen Faktor‑VII-Mangel.2 Zur genauen Diagnose lässt sich die FVII‑Aktivität bestimmen.2 Genetische Tests, vor allem bei positiver Familienanamnese, sind möglich.1